
Con l’evoluzione verso molecole, materiali e sistemi sempre più complessi, emergono nuove sfide di cristallizzazione per prodotti quali i farmaci. La chiave per superare questi ostacoli risiede in una comprensione dei meccanismi fondamentali della solubilità, ovvero la cinetica di cristallizzazione e le forze che la governano. Questa comprensione costituisce la base per sviluppare processi di cristallizzazione continua innovativi, integrati e potenziati.
In questo articolo esploriamo metodi per misurare con precisione la solubilità con diversi solventi e in miscele complesse, come i co-cristalli. Scegliere solventi e miscele che abbraccino un ampio spettro di funzionalità chimiche aumenta al massimo le probabilità di scoprire nuove forme solide, interessanti e sviluppabili nell’ambito della ricerca farmaceutica.
Cosa troverai in questo articolo?
- Un approfondimento sui diversi metodi di misurazione della solubilità.
- Una panoramica dei metodi di misurazione dinamica della solubilità: il metodo della variazione di temperatura (TV) e il metodo dell’aggiunta di solvente (SA).
- L’applicazione dei metodi TV e SA allo screening dei co-cristalli. Gli esperimenti descritti nel whitepaper fanno uso della tecnologia di trasmissività integrata nello strumento Crystal16 e delle telecamere di visualizzazione delle particelle di cui è dotato lo strumento Crystalline di Technobis.

Comprendere la solubilità
La solubilità è definita come la quantità di un composto cristallino che può essere disciolta in un determinato sistema di solventi, in condizioni di processo specifiche, in cui la temperatura rappresenta spesso il parametro più influente. Per molti composti, la solubilità aumenta con la temperatura. Inoltre, la solubilità di un composto può variare notevolmente in base al solvente o al sistema di solventi impiegato.
I dati sulla solubilità sono centrali per prendere decisioni critiche già a partire dalle prime fasi della scoperta di nuovi farmaci, durante tutto il processo di sviluppo e fino alla formulazione. Per molti prodotti, la cristallizzazione viene utilizzata sia per la purificazione che per la formazione delle particelle. Nella cristallizzazione dei principi attivi (IA, active ingredients), la curva di solubilità è un parametro essenziale per scegliere il processo di cristallizzazione più adatto (ad esempio la cristallizzazione per raffreddamento o per evaporazione) e per determinare la resa. Per questo, la conoscenza della solubilità è un elemento imprescindibile nella progettazione del processo di cristallizzazione. Misurare la solubilità richiede un controllo preciso della temperatura e un’osservazione attenta della transizione di fase, ovvero la completa dissoluzione della fase solida, oltre a informazioni sulla composizione del sistema. Poiché in generale è necessario un set di dati di solubilità riproducibile entro un range di temperature o di composizioni, è necessario determinare separatamente molti punti dati, cosa che rende il processo laborioso e dispendioso in termini di tempo. Gli strumenti Crystal16 e Crystalline offrono un prezioso supporto per automatizzare le misurazioni dei parametri relativi alla solubilità in modo rapido, controllabile e riproducibile.
Metodo della concentrazione di equilibrio vs. metodi dinamici
Uno dei metodi più accreditati e accurati per misurare la solubilità è quello dell’equilibrio di una sospensione, seguito dalla valutazione della composizione della soluzione, da cui si può ricavare la concentrazione della soluzione. Questo approccio richiede il campionamento, seguito dalla filtrazione per rimuovere i solidi e dalla misurazione della concentrazione mediante metodi gravimetrici, spettroscopici o cromatografici tra cui l’HPLC (figura 1a). Tuttavia, il metodo della concentrazione di equilibrio (EqC) risulta laborioso e richiede molto tempo.
Si può in alternativa ricorrere a due metodi più accessibili e di più facile impiego: il metodo della variazione di temperatura (TV) e quello dell’aggiunta di solvente (SA). Con il primo si modifica gradualmente la temperatura della sospensione, mentre con il secondo si modifica gradualmente la composizione, in entrambi i casi fino alla completa dissoluzione di tutti i cristalli. Il punto nel diagramma della concentrazione-temperatura in cui la sospensione si trasforma in una soluzione chiara viene chiamato punto di dissoluzione completa. Tale punto può essere determinato utilizzando il metodo TV. La figura 1b illustra il principio della misurazione con variazione della temperatura (TV), in cui i cristalli in sospensione si dissolvono mediante riscaldamento. A una temperatura specifica, chiamata punto di dissoluzione completa, i cristalli non sono più rilevabili. Il metodo dell’aggiunta di solvente (SA) consente di determinare la composizione al punto di dissoluzione completa a temperatura costante. La figura 1c mostra il principio del metodo SA, in cui i cristalli in sospensione si dissolvono mediante diluizione.
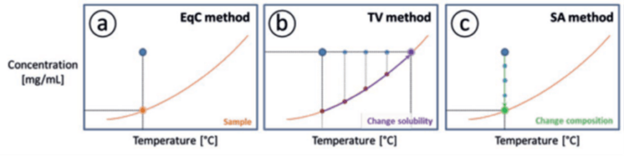
Il punto di dissoluzione totale può essere considerato uguale alla solubilità se la velocità di riscaldamento o di aggiunta è sufficientemente lenta. Rispetto al metodo della concentrazione di equilibrio, questi metodi dinamici risultano vantaggiosi in quanto meno laboriosi, più rapidi e mono soggetti al rischio di errore umano, per via del minor numero di operazioni necessarie (non è richiesto il campionamento o la filtrazione). Oltre alla velocità di riscaldamento o di aggiunta e all’accuratezza della determinazione del punto di dissoluzione totale, l’errore nelle misurazioni della solubilità dipende anche dal sistema chimico. Ad esempio, se si formano dei cristalli sulla parete al di sopra del livello del liquido nel contenitore utilizzato per la misurazione, la solubilità misurata risulterà diversa dal valore effettivo, poiché parte della fase solida resterà non disciolta.
I metodi TV e SA hanno inoltre dimostrato di fornire dati affidabili e riproducibili in tempi brevi per un numero considerevole di sistemi, come testimoniato dall’alto numero di articoli scientifici pubblicati ogni anno.
Il metodo TV è particolarmente adatto per determinare la linea di solubilità dipendente dalla temperatura di un composto in un solvente. Riscaldando una sospensione avente composizione nota, la temperatura alla quale tutti i cristalli si dissolvono segna un punto sulla linea di solubilità. Dopo una fase di ricristallizzazione mediante raffreddamento, è possibile ripetere la misurazione. Un ulteriore vantaggio di queste misurazioni cicliche è che, durante la fase di raffreddamento, è possibile registrare la temperatura alla quale ricompaiono i primi cristalli, nota come punto di intorbidimento. La misurazione dei punti di intorbidimento determina la larghezza della zona metastabile (MSZW), che serve a determinare l’intervallo operativo del processo e indica la tendenza alla nucleazione primaria. Con lo strumento Crystal16 è possibile effettuare 16 misurazioni di solubilità utilizzando un volume di campione pari a 1 mL. La misurazione di più campioni simultaneamente fornisce un set di dati comprendente le temperature di saturazione a diverse concentrazioni che rappresentano la linea di solubilità.
Quando occorrono dati sulla solubilità a temperatura costante, come spesso accade nelle miscele multicomponente, il metodo SA si rivela la scelta ideale. Il metodo risulta inoltre molto utile in sistemi la cui solubilità non dipende fortemente dalla temperatura oppure in cui la zona metastabile (MSZ) è ampia. Questo metodo, tuttavia, non misura l’ampiezza della zona metastabile (MSZW). Nel metodo di aggiunta di solvente, la temperatura viene mantenuta costante. Diluendo una sospensione a composizione nota mediante l’aggiunta di solvente, si rileva il punto di dissoluzione totale quando viene raggiunta la concentrazione di equilibrio. Il punto di dissoluzione totale può essere rilevato tramite una diminuzione della concentrazione della soluzione o la scomparsa dei cristalli. Quest’ultima situazione è mostrata nella figura 3, in cui viene utilizzato lo strumento Crystalline per monitorare la sospensione attraverso le telecamere di visualizzazione delle particelle. Le telecamere acquisiscono immagini a intervalli regolari e il punto di dissoluzione totale viene fissato in corrispondenza della prima immagine senza cristalli. Riducendo l’intervallo di tempo tra le immagini si aumenta quindi l’accuratezza del punto di dissoluzione totale. Nel metodo SA, il parametro principale è la velocità di aggiunta, che deve essere sufficientemente bassa affinché la dissoluzione possa procedere correttamente nel tempo.

Conclusioni
L’uso di tecniche automatizzate per misurare il punto di intorbidimento/dissoluzione totale, sia tramite analisi della torbidità che con l’ausilio di telecamere, ha notevolmente accelerato l’acquisizione dei dati sulla solubilità. L’uso del metodo del punto di intorbidimento/dissoluzione totale per la determinazione della solubilità con lo strumento Crystal16 e i relativi sensori di torbidità consente agli scienziati di ottenere e riprodurre facilmente i dati, con uno sforzo molto minore rispetto al metodo della concentrazione di equilibrio (EqC). Il metodo dell’aggiunta di solvente, abbinato alle telecamere dello strumento Crystalline e al suo visualizzatore di particelle, è una tecnica ampiamente utilizzata per determinare la solubilità a temperatura costante e per generare rapidamente diagrammi di fase isotermici. Tali metodi trovano quindi ampia applicazione in numerosi laboratori a livello globale, sia nell’industria che nel mondo accademico.
Ogni anno oltre 25 articoli scientifici evidenziano l’uso degli strumenti Crystal16 e Crystalline per tali misurazioni.
Bibliografia
[i] Reus, M.A.; A.E.D.M. van der Heijden; J.H. ter Horst; Org. Process. Res. Dev. 2015, 19 (8), 1004-1011.
[ii] Vellema, J.; Hunfeld, N.G.M.; Van den Akker, H.E.A.; ter Horst, J.H.; Eur. J. Pharm. Sci. 2011, 44, 621-626
Vuoi saperne di più?
Scarica il whitepaper completo “Solubility: Importance, Measurements and Applications” qui. È inoltre possibile esplorare altri casi di studio nella knowledge library di Technobis.





